Take home message
・心停止後症候群は、心停止後脳損傷、心停止後心機能障害、全身虚血/再灌流反応、心停止の原因となった病態の組み合わせて複雑な病態を呈する
・ROSC後は速やかに一般的な集中治療を開始すると共に心停止の原因を評価する
・心筋虚血による心停止が疑われれば(ECGでST上昇、循環動態不安定、VF/VTなど)、緊急CAG/PCIを検討する
・ROSC後も昏睡状態の患者では、体温管理療法(TTM)を行い、少なくとも72時間は高体温を避ける
・TTMの方法としては、体の露出、解熱薬、冷却デバイスなどを用いる
・神経学的予後予測は、神経診察、脳画像検査、NSE、脳波など複数の項目を用いて多角的に行う
PCAS(心停止後症候群)の病態生理
心停止後には、全身の虚血と再灌流によって臓器障害が出現する。さらに、心停止に至った病態も加わり全体としては複雑な病態を呈する。
PCASの病態としては、「心停止後脳損傷」「心停止後心筋機能障害」「全身虚血/再灌流反応」「心停止の原因となった病態」の4つに大きく分けられる。
「心停止後脳損傷」
・病態生理
脳血管の自動調節能障害、脳浮腫、虚血後神経変性
・臨床症状
昏睡、けいれん発作、認知機能障害、持続的な植物状態、二次性パーキンソニズム、皮質梗塞、脊髄梗塞、脳死
「心停止後心筋機能障害」
・病態生理
びまん性運動低下(心筋麻痺)、急性冠症候群
・臨床症状
心拍出量低下、低血圧、不整脈、循環不全
「全身虚血/再灌流反応」
・病態生理
全身性炎症反応症候群(SIRS)、血管調整障害、凝固亢進、副腎機能抑制、組織の酸素供給/利用の障害、免疫能低下
・臨床症状
進行性の組織低酸素/虚血、低血圧、循環不全、発熱、高血糖、多臓器不全、感染症
「心停止の原因となった病態」
個々の病態に準じる
心停止患者の蘇生後マネジメント
迅速な蘇生後管理の開始
・蘇生後管理は、場所に依らず、自己心拍再開(ROSC)が維持できている患者に対して速やかに開始する
・院外心停止の場合は、速やかに蘇生後管理のできる施設に搬送する
心停止の原因診断
・臨床的(ex.循環動態不安定など)または心筋虚血の所見がある場合は、まず冠動脈造影を行う
・冠動脈造影で原因となる病変を認めない場合は、頭部CT/肺動脈造影CTを行う
・呼吸器系、神経系の原因は、入院時の頭部CT/胸部CTで特定できる
・心停止前に呼吸器系、神経系の原因を示唆する所見(頭痛、痙攣、神経脱落症状、息切れ、呼吸器疾患のある患者の低酸素など)があれば、頭部CT/肺血管造影CTを施行する
気道と呼吸管理
ROSC後の気道管理
・短時間の心停止で、速やかに正常の脳機能に戻った場合は気管挿管の必要はない
・ROSC後に昏睡のまま、もしくは他の理由で鎮静や機械換気が必要な場合は、CPR中に気管挿管が行われていなければ施行する
・気管挿管は、成功率の高い経験豊富な者が行う
・挿管チューブの適切な位置はカプノメーターで確認する
・気管挿管の経験のある者がいない状況では、気管挿管ができる者が現れるまで声門上器具を使用するか、基本的な手技で気道確保を行う
酸素化の調整
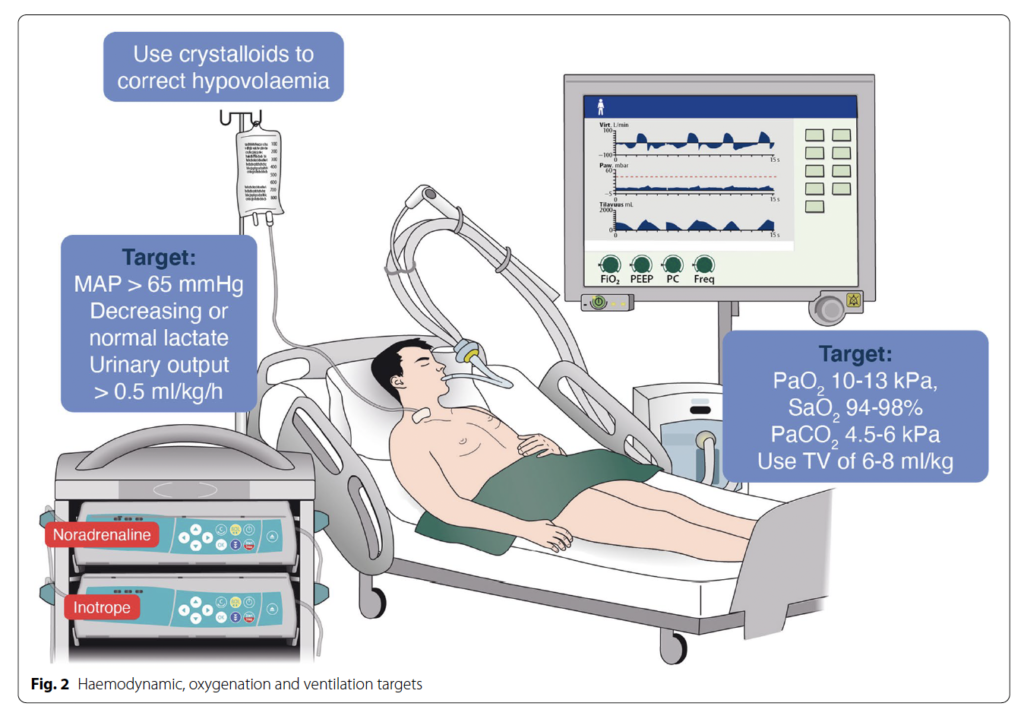
・ROSC後は、動脈酸素飽和度もしくは動脈酸素分圧が確実に測定できるまで、100%の酸素投与(もしくは使用できる最大量)を使用する
・測定できるようになったら、動脈酸素飽和度 94-98%または酸素動脈分圧 75-100mmHgとなるように酸素投与量を調整する
・ROSC後の低酸素血症(PaO2 < 60mmHg)や高酸素血症は避ける
換気の調整
・機械換気を行っている患者では、動脈ガスとEtCO2を使用する
・ROSC後に機械換気を必要とする患者では、正常PaCO2(35-45 mmHg)を目標となるように調整する
・標的温度管理(TTM)で治療される患者は、低CO2血症となることがあるためPaCO2を頻回に測定する
・TTMを行う場合は、血液ガスの補正のために温度または非温度の補正を一貫して使用する
・一回換気量を6-8mL/kg(理想体重)を目標とする肺保護換気を行う
循環の管理
冠動脈再灌流
・緊急CAG(必要に応じてPCI)は、心電図でST上昇があり心原性の心停止が疑われる患者で施行する
・心電図でST上昇のない院外心肺停止ROSC後患者では、急性冠動脈閉塞の可能性が高いと推測される場合(ex.循環動態不安定 and/or 電気学的不安定)に緊急CAGを考慮する
循環動態のモニタリングとマネジメント
・すべての患者は、持続的血圧測定のためにA lineでモニタリングされるべき
・すべての患者で可能な限り早期に心エコーを行い、背景にある心臓病態を評価し、心筋障害の程度を評価する
・低血圧(MAP < 65mmHg)は避け、適切な尿量(> 0.5 mL/kg/h)と乳酸値の正常化または低下を達成するMAPに調整する
・33℃のTTMを行う場合、血圧、乳酸値、ScvO2 or SvO2が適切であれば徐脈は治療する必要はないが、いずれかに異常を認める場合は目標体温を36℃以下に引き上げることを検討する
・患者の血管内容積、血管拡張、心収縮に応じて輸液、ノルアドレナリン、ドブタミンを使用して臓器灌流を維持する
・心停止後にルーチンにステロイドは投与してはいけない
・心室性不整脈に関連するため、低K血症を避ける
・蘇生輸液、強心薬、血管収縮薬を使用しても左室機能不全による心原性ショックが持続する場合は、機械的循環補助(IABP、LVAD、VA-ECMOなど)の使用を検討する
・最適な治療にもかかわらず循環動態不安定なACSや再発性VT/VFにおいても機械的循環補助は考慮される
神経学的回復の最適化
発作の制御
・脳波(EEG)を使用して臨床的に痙攣している患者の電気的発作を診断し、治療効果のモニタリングを行うことを推奨する
・心停止後の発作の治療には、鎮静薬に加えて第一選択の抗てんかん薬としてレベチラセタムまたはバルプロ酸を推奨する
・蘇生後患者にルーチンの発作予防薬は使用すべきではない
体温の調整
・ROSC後に昏睡状態の患者では、持続的な深部体温のモニタリングをし、体温管理療法(TTM)を推奨する(院内/院外心停止に関わらず)
・少なくとも24時間は32〜36℃となるように体温を維持する
・昏睡状態が続いている患者は、ROSC後少なくとも72時間は高体温(>37.7℃)を避ける
・体温調整は、患者を露出させる、解熱薬を使用する、不十分であれば37.5℃を目標とする冷却デバイスを使用することで行う
・平温管理を行うためにROSC後昏睡状態の軽度の低体温患者を積極的に加温するのは推奨しない
・病院前において、ROSC後すぐに冷点滴の急速大量投与で冷却するのは推奨しない
一般的な集中治療管理
・短時間作用の鎮静薬、オピオイドを使用する
・TTMを行っている患者にルーチンに筋弛緩薬を使用することは避けるが、TTMの間に重度のシバリングがある場合は使用が考慮される
・蘇生後患者にはルーチンにストレス潰瘍予防を行う
・DVT予防を行う
・必要に応じてインスリンを使用し、血糖を140-180mg/dLに管理し、低血糖(<70mg/dL)は避ける
・TTMの間は少量で経腸栄養を開始し、復温後に必要に応じて増量する
・TTMの目標を36℃とすると、TTMの間でも早期に経腸栄養を増量できる可能性がある
・ルーチンの予防的抗菌薬投与は推奨しない
予後評価
概要
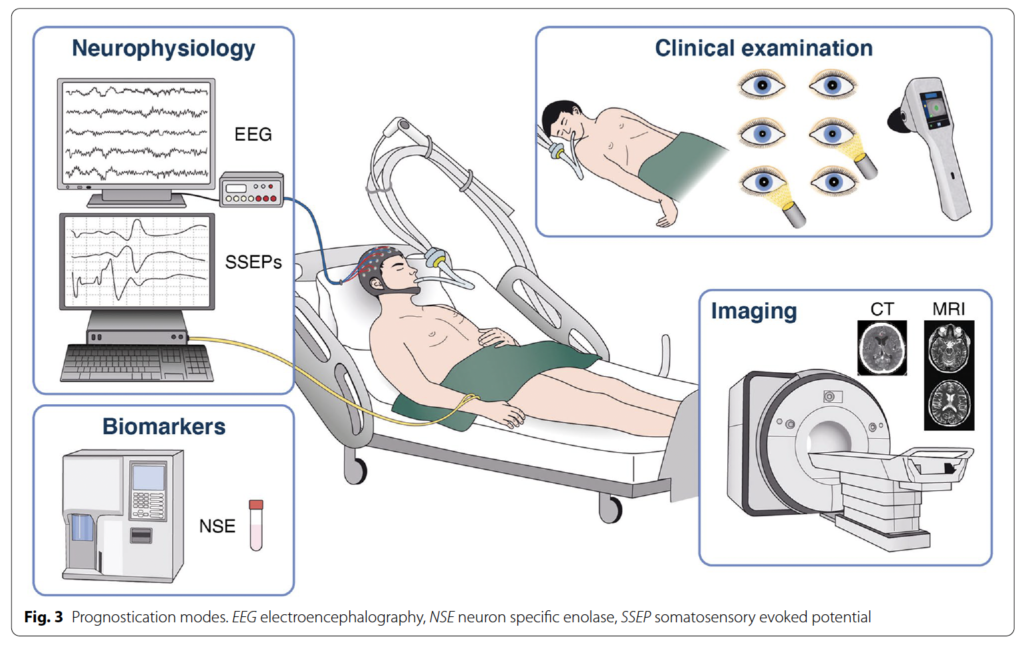
・心停止から蘇生後に昏睡状態にある患者では、診察、脳波、バイオマーカー、画像検査を使用して神経学的予後予測を行うべきであり、患者の親族に情報提供をし、臨床医が神経学的に有意な回復の見込みにがあるかどうかに基づいて治療目標を定める
・100%正確な予測因子はないため、複数の所見で神経学的予後予測を行うことを推奨する
・神経学的予後が不良であることを予測する場合、誤った悲観的な予測を避けるために高い特異性と精度が望ましい
・神経診察は予後予測の中心となる所見であり、所見を修飾する鎮静薬やその他の薬剤は中止するべき
・TTMで治療する場合、毎日の診察が推奨されるが最終的な予後評価は復温した後に行われるべき
・神経学的予後予測のための検査は、低酸素脳症の重症度を評価することを目的としている
・神経学的予後は、患者の回復の可能性に関する議論で考慮されるべき側面の1つである
多角的予後予測
・主要な交絡因子(鎮静薬、低体温など)が取り除かれた状態で、正確な検査を行い神経学的予後評価を行う
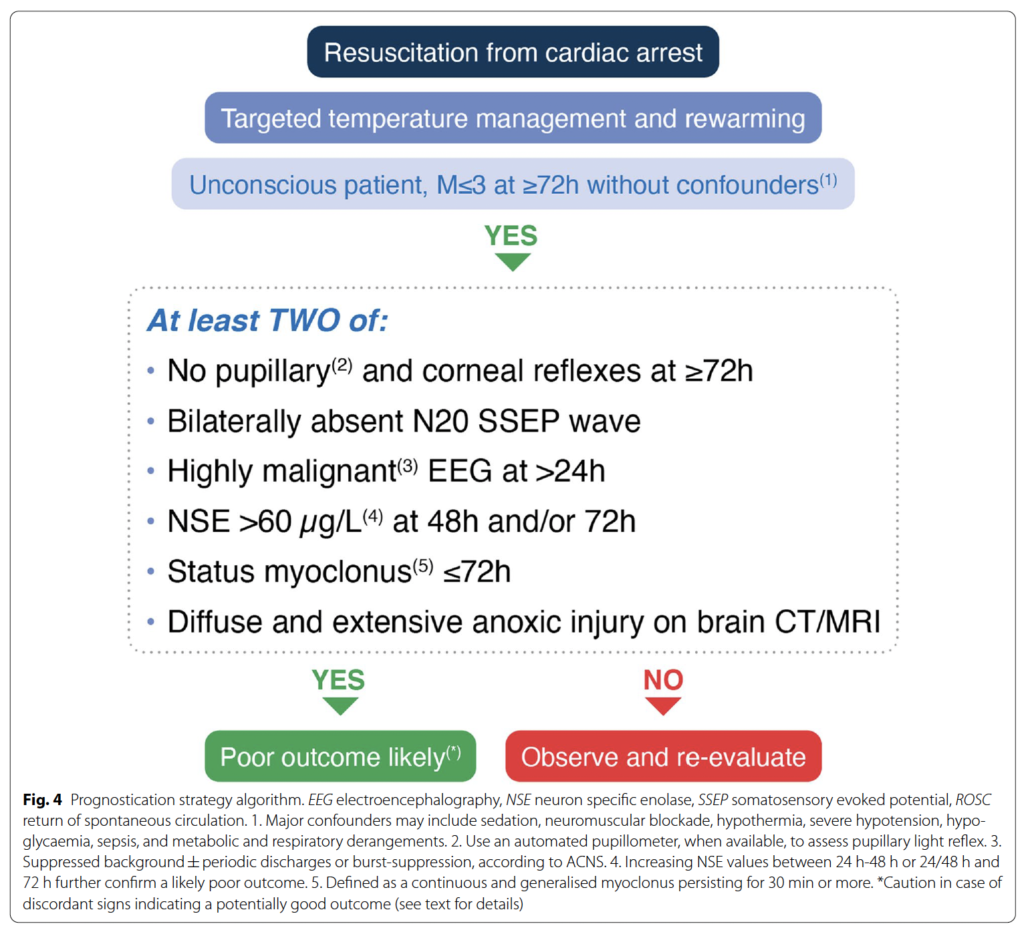
・ROSCから72時間以上でGCS M≦3の昏睡患者では、次の2つ以上の因子が存在する場合、予後不良の可能性がある
①72時間以降に対光反射および角膜反射が消失している場合
②24時間以降に両側でのN20 SSEPが消失している場合
③24時間以降に高い悪性度の脳波所見の場合
④48時間以降 and/or 72時間以降のNSE ≧ 60 μg/Lの場合
⑤72時間以内にミオクローヌス持続状態がある場合
⑥脳CT/MRIでびまん性で広範な低酸素脳症の所見がある場合
診察所見
・診察所見は、鎮静薬、オピオイド、筋弛緩薬の影響を受けやすい
・鎮静薬の遷延の影響は常に考慮され、その可能性は除外されるべき
・ROSC後72時間以降でGSC M≦3の場合は、神経学的予後評価が必要になる
・ROSC後72時間以降も昏睡状態のままの場合、以下の所見があると神経学的予後不良を示唆する
-対光反射が両側で消失
-両側の角膜反射の消失
-96時間以内のミオクローヌスの出現、特に72時間以内でミオクローヌスが持続する場合
・関連するてんかん様活動を検出するため、もしくは、神経学的回復を示唆する背景活動や連続性などの脳波徴候を同定するためにミオクローヌス発作があるときの脳波を記録することを提案する
脳波
・心停止後に意識障害のある患者に脳波を行う
・非常に悪性の脳波パターンは、「抑制された背景活動 ± 周期的な放電やバーストサプレッション」
・TTM終了後、鎮静が終了された後のこれらの脳波所見を予後不良の指標として使用することを推奨する
・ROSC後72時間以内での脳波上での明確な発作の存在は予後不良の指標
・心停止後の脳波で背景活動の消失は予後不良の指標
・両側性の体性感覚誘発電位(SSEP) N20の消失は予後不良の指標
・SSEPを実施する場合は筋弛緩薬の使用を検討する
・診察所見やその他の検査とともに、脳波やSSEPの結果を常に考慮すべき
バイオマーカー
・心停止後の神経学的予後予測には、NSEの連続測定を他の方法と併用する
・24時間後と48時間後または72時間後で値が上昇していることと48時間後と72時間後の値が高値であることは予後不良を示す
画像検査
・心停止後の神経学的予後不良の予測に他の検査と組み合わせて、画像検査を用いる
・脳CTでびまん性脳浮腫、灰白質/白質比の顕著な減少、または、脳MRIで広範な拡散制限は、予後不良を示唆する
NSEの測定について
・国内外でのガイドラインでは、予後予測の指標の1つとしてNSEを測定することは共通して推奨している
・一方で、欧州のガイドラインではカットオフ値を≧60μg/Lとしているが日本/欧米のガイドラインでは定めておらず、明確な基準はない
・過去の観察研究では、カットオフ値は33〜120μg/Lの範囲として6ヶ月後の神経学的予後不良を予測していることが多い
・評価するタイミングも「48時間と/または72時間」「48-72時間」「72時間以内」などまちまち
生命維持療法の中止
・生命維持装置の中止(WLST)についてと神経学的予後の評価に関する議論は別に行う
・WLSTの決定は、脳損傷の程度以外に年齢、併存疾患、全般的な臓器機能、患者の希望などを考慮すべきである
・チーム内および親族と治療レベルを決定するためのコミュニケーションのために十分な時間を作る
心停止後の長期的な予後
・退院前に身体的障害および非身体的障害の機能評価を行い、早期のリハビリテーションが必要か判断し、リハビリテーションにつなげる
・退院後3ヶ月以内に、すべての心停止後患者のフォローアップをし、以下を含めた評価を行う
①認知障害のスクリーニング
②感情的な問題や疲労に関するスクリーニング
③生存者と家族に情報と支援を提供する
臓器提供
・臓器提供に関するすべての決定は、現地の法的および倫理的要件について従う必要がある
・臓器提供は、ROSCが達成され、死亡の神経学的基準(脳死基準)を満たした場合に検討されるべき
・死亡の神経学的基準を満たさない昏睡状態の機械換気を受ける患者においては、終末期ケアの開始と生命維持の終了が決定された場合、心停止に至ったときに臓器移植を考慮すべき
参考文献
ERC/ESICM 蘇生後ガイドライン: Intensive Care Med. 2021;47:369-421.(PMID: 33765189)
ERC/ESICM 蘇生後TTM ガイドライン:Intensive Care Med. 2022;48:261-269.(PMID: 35089409)
AHA 蘇生後ガイドライン:Circulation. 2015;132:S465-82.(PMID: 26472996)
Circulation. 2008 Dec 2;118(23):2452-83.(PMID: 18948368)
JRC 蘇生ガイドライン 2020 成人の二次救命処置







コメント